Guía Metodológica Estructura Interna de la Materia
DESCARGAR
Material de trabajo Estructura Interna de la materia
DESCARGAR
Dibujos Estructura Interna de la materia
DESCARGAR
Taller de Estructura Interna de la materia
GUIA METODOLOGICA ESTRUCTURA
INTERNA DE LA MATERIADESCARGAR
Material de trabajo Estructura Interna de la materia
DESCARGAR
Dibujos Estructura Interna de la materia
DESCARGAR
Taller de Estructura Interna de la materia
1.
Realizar un listado de términos del material de estudio (títulos, subtítulos y
palabras en negrita) – Estudiante - Actividad en clase.
2.
Construir una sopa de letras con la lista de términos anterior – Estudiante -
Actividad extraclase.
3.
Leer, analizar, comprender, interpretar el material de estudio – Estudiante –
Actividad en clase y extraclase.
4.
Construir los conceptos - Estudiante – Actividad en clase y extraclase.
Un
concepto corresponde a una pregunta, su correspondiente respuesta y un dibujo,
grafica, esquema, que explique el concepto construido.
5.
Construir un mapa conceptual del tema en estudio – Estudiante – Actividad
extraclase.
6.
Socializar los conceptos, con el apoyo de videos, dibujos, graficas,
presentaciones en Word, power point, etc, con el fin de corregir los conceptos
errados – Estudiantes y docente – Actividad en clase.
7.
Evaluación: Talleres escritos en clase y extraclase, exposiciones, evaluación
oral y escrita, participación, etc.- Estudiante - Actividad en clase.
8.
Socializar los resultados de los talleres, evaluaciones, exposiciones, etc.-
Estudiante y docente – Actividad en clase.
CONSTRUCCIÓN
DE CONCEPTOS ESTRUCTURA INTERNA DE LA MATERIA
ESTRUCTURA DEL ÁTOMO
1. ¿Qué probaron los experimentos realizados a
finales del siglo XIX y comienzos del siglo XX? ¿Qué propiedad permitieron
conocer estas experiencias relacionada con el átomo?
2. ¿Cómo están conformados los átomos?
3. ¿Qué es el núcleo del átomo?
4. ¿Qué son los protones (p+)?
5. ¿Qué son los neutrones (n)?
6. ¿qué partículas forman la corteza del átomo?
7. ¿Qué son los electrones (e-)?
8. ¿Por qué el núcleo del átomo posee carga
positiva?
9. ¿Por qué la corteza del átomo posee carga
negativa?
TEORIAS
SOBRE LA EXISTENCIA DE LOS ÁTOMOS
10. ¿Cuál es la idea central del pensamiento
griego sobre la composición de la materia?
11. ¿Cuál fue el planteamiento del filósofo
demócrito relacionado con la composición de la materia?
12. ¿Cuáles fueron los planteamientos acerca de
la materia de la composición de la materia expuestos por Jhon Daltón y cuál fue
su error?
13. A finales del siglo XIX, los estudios y
demostraciones que habían sobre los fenómenos eléctricos llevaban a sospechar
que los átomos eran divisibles. ¿Cuáles fueron las experiencias
realizadas por J.J Thomson para confirmar este hecho y qué postulado surgió de
estas experiencias?
14. Según Thomson la materia es neutra y por
tanto los átomos que lo constituyen, de acuerdo con lo anterior. ¿Cuál fue el
modelo de átomo que sugirió Joseph Thomson teniendo en cuenta que si los átomos
contuvieran partículas negativas, deberían contener también partículas
positivas que los contrarrestaran?
15. ¿Qué observó Eugen Goldstein en sus
experiencias al utilizar un tubo de rayos catódicos modificado que contenía el
cátodo perforado y cuál fue su postulado?
16. ¿Qué reveló el descubrimiento del electrón
y del protón?
17. ¿Qué comprobó James Chadwick con sus
experiencias en el año 1932?
MODELO ATÓMICOS
18. ¿En qué consistió el experimento del
neozelandés Ernest Rutherford?
19. ¿Cuáles fueron los resultados del
experimento realizado por Ernest Rutherford?
20. Ernest Rutherford propuso un modelo atómico
de acuerdo con sus resultados. ¿Qué nombre recibe este modelo y en qué consiste?
21. ¿Cuáles son los postulados de la física
clásica?
22. Según los postulados de la física clásica
los átomos son inestables, lo cual no es correcto. Esta contradicción fue
resuelta por Niels Bohr en 1913 al formular un nuevo modelo atómico ¿En qué
consistía este nuevo modelo atómico?
23. ¿Qué estudios realizó Niels Bohr para
determinar su modelo atómico y que logró observar?
24. ¿Cuáles son los postulados del modelo
atómico de Niels Bohr?
25. ¿Qué plantea el principio de incertidumbre
de Werner Heisenberg?
26. ¿Cómo se llama el modelo atómico actual y
qué estableces?
DIAGRAMAS ATÓMICOS
27. ¿Qué
son los diagramas atómicos y para qué sirven?
NUMERO ATÓMICO
28. ¿Qué es el número atómico y cómo se
simboliza?
29. ¿Qué determina el número atómico (Z) y de
ejemplos?
30. ¿Qué caracteriza a un átomo de acuerdo a su
número atómico (Z) y de ejemplos?
31. Identifique en la tabla periódica los
elementos de los grupos IA y IIA pertenecientes a la región S (metales ligeros).
Escriba el nombre, símbolo y el número atómico (Z) de cada uno de ellos.
32. Identifique en la tabla periódica los
elementos de los grupos IIIA, IVA, VA, VIA, VIIA y VIIIA pertenecientes a la región
p (no metales). Escriba el nombre, símbolo y el número atómico (Z) de cada uno
de ellos.
33. Identifique en la tabla periódica los
elementos de los grupos IIIB, IVB, VB, VIB, VIIB, VIIIB, IB y IIB
pertenecientes a la región D (elementos de transición). Escriba el nombre,
símbolo y el número atómico (Z) de cada uno de ellos.
NUMERO MÁSICO
34. ¿Qué es el número másico, como se
representa y de ejemplos?
ARQUITECTURA ELECTRÓNICA
35. ¿Cuáles son las reglas básicas de acuerdo a
los principios de la teoría mecánico-cuántica para distribuir los electrones
dentro del átomo?
36. Realiza el cuadro donde puedes apreciar:
a). Los
orbitales que hay en cada nivel de energía.
b). La
capacidad máxima de electrones que pueden contener los niveles y subniveles de
energía.
37. ¿Cómo se organizan los electrones en el
átomo?
38. ¿Qué son las orbitas u orbitales y que los
caracteriza?
39. ¿Qué son los subniveles de energía?
40. ¿Qué determinan los números cuánticos?
41. ¿Qué indica el diagrama de Moller y realice
su esquema de representación?
42. De acuerdo con el modelo mecánico cuántico de
la materia ¿Dónde se encuentran localizados los electrones en un átomo?
43. ¿Cuáles son los criterios a tener en cuenta
para la distribución de los electrones en los niveles y subniveles de energía en
un átomo? Explique cada uno de ellos.
44. ¿A qué se le denomina configuración
electrónica de un átomo?
45. ¿Para qué sirve la notación electrónica?
46. La escritura de la notación electrónica comprende
algunos símbolos. Indique cada uno de ellos.
47. ¿Cuáles son los electrones de valencia?
48. ¿Cuál es la importancia de las
configuraciones electrónicas en el estudio de los elementos químicos?
49. ¿Qué se necesita para escribir la
configuración electrónica de un átomo?
50. Existe una forma sencilla de escribir la
configuración electrónica de un átomo. ¿Cómo se llama?
51. En los diagramas orbitales ¿Cómo se
representa cada orbital y de ejemplos?
52. ¿Qué principios se cumplen cuando un
subnivel tiene más de un orbital?
53. ¿Qué dice el principio de Pauli?
54. ¿Qué establece la regla de Hund?
55. Realice el cuadro dónde se pueden apreciar
las configuraciones de los 10 primeros elementos químicos de la tabla
periódica.
IONES
56. ¿Qué significa que un átomo sea
eléctricamente neutro?
57. ¿Qué sucede si un átomo gana o pierde
electrones?
58. ¿Qué sucede cuando un átomo neutro gana uno
o más electrones?
59. ¿Qué sucede cuando un átomo neutro pierde
uno o más electrones?
60. ¿Qué sucede con el número de protones y
electrones en la formación de un ion? De ejemplos.
61. ¿Qué se necesita para que un átomo se
convierta en un catión?
62. ¿Qué sucede con un átomo que pierde un
electrón?
63. ¿Qué sucede con un átomo que pierde dos
electrones?
64. ¿Cómo se representan los iones?
ISÓTOPOS
65. ¿Qué sucede con los átomos de un mismo
elemento?
66. ¿Qué son los isótopos?
67. Realice la tabla donde se pueden apreciar
los isótopos de hidrógeno y del carbono.
68. Escriba el ejemplo sobre el elemento 1327X
y analice las siguientes preguntas relacionadas con el ejercicio.
¿Cuántos protones, neutrones y electrones tendrá
el elemento? ¿Y si forma un catión trivalente?
¿Y si tuviéramos el isótopo 29 de este elemento?
CONSTRUCCIÓN DE CONCEPTOS ESTRUCTURA INTERNA DE LA MATERIA
3. ¿Qué es el núcleo del átomo?
12. ¿Cuáles fueron los planteamientos acerca de
la composición de la materia expuestos por Jhon Daltón y cuál fue su error?
13. A finales del siglo XIX, los estudios y
demostraciones que habían sobre los fenómenos eléctricos llevaban a sospechar
que los átomos eran divisibles. ¿Cuáles fueron las experiencias realizadas por
J.J Thomson para confirmar este hecho y qué postulado surgió de estas
experiencias?
14. Según Thomson la materia es neutra y por
tanto los átomos que lo constituyen, de acuerdo con lo anterior. ¿Cuál fue el
modelo de átomo que sugirió Joseph Thomson teniendo en cuenta que si los átomos
contuvieran partículas negativas, deberían contener también partículas
positivas que los contrarrestaran?
15. ¿Qué observó Eugen Goldstein en sus
experiencias al utilizar un tubo de rayos catódicos modificado que contenía el
cátodo perforado y cuál fue su postulado?
20. Ernest Rutherford propuso un modelo atómico
de acuerdo con sus resultados. ¿Qué nombre recibe este modelo y en qué consiste?
22. Según los postulados de la física clásica
los átomos son inestables, lo cual no es correcto. Esta contradicción fue
resuelta por Niels Bohr en 1913 al formular un nuevo modelo atómico ¿En qué consistía
este nuevo modelo atómico?
23. ¿Qué estudios realizó Niels Bohr para
determinar su modelo atómico y que logró observar?
24. ¿Cuáles son los postulados del modelo
atómico de Niels Bohr?
25. ¿Qué plantea el principio de incertidumbre
de Werner Heisenberg?
27. ¿Qué
son los diagramas atómicos y para qué sirven?
28. ¿Qué es el número atómico y cómo se
simboliza?
34. ¿Qué es el número másico, como se
representa y de ejemplos?
35. ¿Cuáles son las reglas básicas de acuerdo a
los principios de la teoría mecánico-cuántica para distribuir los electrones
dentro del átomo?
Los
orbitales que hay en cada nivel de energía.
La
capacidad máxima de electrones que pueden contener los niveles y subniveles de energía.
39. ¿Qué son los subniveles de energía?
65. ¿Qué sucede con los átomos de un mismo
elemento?
66. ¿Qué son los isótopos?
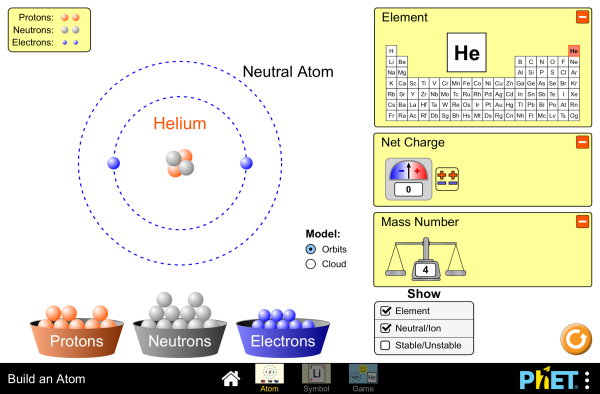
SIMULACIÓN: CONSTRUCCIÓN DE ALGUNOS ÁTOMOS